
常见问题
 2023-10-19
2023-10-19 1. 无信号/荧光强度弱
补偿问题
多色流式配色很关键,低表达的抗原可以用相同荧光素的高表达抗原代替,或者使用补偿微球。
用于检测的抗体不足
一定要做抗体滴定,按照说明书的要求加抗体。
无法接近细胞内靶标
确定好抗原的表达位置,选择合适的染色方法和刺激方法。
激光器未对齐
做实验前一定要确保仪器没有问题。流式细胞仪是流式的三大基本要素之一,要经常维护仪器,做质控,并清洗仪器。确保流式细胞仪上的激光器正确对齐,必要时通过运行液流检查微珠来调整路线。如果激光器未正确对齐或发生偏移,则可能需要考虑维修机器。
靶蛋白不存在/低水平表达
确保您正在分析的组织/细胞类型能表达靶蛋白,并且靶蛋白的量足以被检出。
细胞因子类marker
正常的淋巴细胞处于未激活状态,不会分泌细胞因子。因此要选择合适的方法激活淋巴细胞,使其释放细胞因子,达到检测水平。同时要加蛋白转运抑制剂使其留在胞内,然后固定破膜,染相应抗体。细胞刺激剂、蛋白转运抑制剂以及固定破膜的试剂的选择都会影响染色结果。
荧光淬灭
抗体可能存放太久或没有避光。还要考虑固定试剂的问题。
一抗和二抗不匹配
使用的二抗应与一抗来源种属不同(例如,一抗为兔源,则应该使用抗兔源二抗)。为了解决种属交叉反应性的问题,您可以使用经流式细胞术验证的直接偶联一抗,或者使用偶联物试剂盒,在您选择的抗体中加入合适的荧光染料。
2. 荧光强度高
抗体浓度过高
做抗体滴定。
过量抗体被捕获
胞内染色特有的问题。染色后,充分清洗。也有可能是破膜剂的问题,破膜不够充分。
无法接近细胞内靶标
确定好抗原的表达位置,选择合适的染色方法和刺激方法。
封闭不足
做Fc受体阻断是一个特别好的流式习惯,但不是所有的细胞都需要做封闭,做封闭是为了减少非特异性结合。
3. 背景高/阳性细胞百分比高
增益设置过高/补偿过低
使用阳性对照正确设置流式细胞仪,使用补偿减少小颗粒背景信号并减少增益,以降低信号。
抗体过量
抗体滴定。清洗充分。
4. 在应该只有1个细胞群时观察到2个或以上
表达目的marker的细胞群不止一个
做实验前要确定好目的细胞的目的marker。
出现细胞双峰
细胞双峰显示为第二大细胞群,其荧光强度大约是单细胞荧光强度的两倍。制样和上机的过程要确保是单细胞悬液,并且过滤掉大的组织团块。
一定要做抗体滴定,按照说明书的要求加抗体。
5. 侧向散射背景偏高(来自小颗粒)
细胞裂解
制样问题,保证细胞的活力,不能有太多碎片。注意离心条件和涡旋力度。
细菌污染
确保样本不受污染。细菌会自动发出较弱的荧光,导致高事件率。
去死活
样本制备不可避免的会出现细胞死亡或坏死,特别是实体组织制备的单细胞悬液,一定要染死活,不染自发荧光会很高,干扰实验结果。
6. 其他
细胞量
正常1×106个细胞/100 μL体系中染色。表达量高的膜表面分子可以体系减半抗体减半。固定破膜的过程中,会损失掉一些细胞。因此,表达量低、胞内、核内分子可以加大细胞量,相应体积的抗体也可以对应细胞量多加,一定要做预实验和抗体滴定,摸索最佳染色效果。
电压
裸细胞调完FSC、SSC的电压,记得调荧光通道的电压。
对照
一定要设置好对照组,补偿对照、阴性对照、阳性对照(生物学对照)、同型对照、FMO对照。
细胞聚集,阻塞管道
制样的过程中一定要确保是单细胞悬液,制样和上机的时候过滤掉组织团块。
固定
某些荧光素对多聚甲醛敏感,要注意,可以选择成品、温和的固定液。如果固定过夜,上机前要清洗掉多聚甲醛再上机。
 2023-11-18
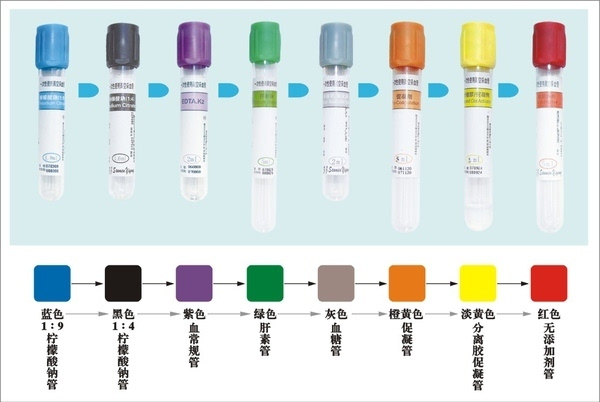
2023-11-18 A: 以外周血样本为例,使用EDTA抗凝管(紫色盖)收集,
收集外周血时,上下混匀,保证和抗凝剂混合均匀
 2023-11-26
2023-11-26 Q1,我们WB实验结果为何出现2条带?
A:
通过与阴性样品的对比,可以确定该条带是否为杂带。
若该条带并非杂带,则该条带产生的可能原因有:
目的蛋白被修饰所产生的条带;
目的蛋白被剪切所产生的条带;
目的蛋白被降解所产生的条带;
如果是原核表达纯化的重组蛋白,可能是降解或非共价结合未被打断的二聚体所产生的条带。
Q2,为什么阴性样品也有疑似条带?
A:
阴性样品中内源的目的蛋白或敲除不完全的目的蛋白或未被敲除的目的蛋白isoform,或者是与目的蛋白大小相同的杂带。
Q3,腹水和小鼠血清有交叉反应,是否属于正常?如果纯化后是否能够解决这个问题?
A:
小鼠腹水得到的抗体肯定会对小鼠血清有亲和性,出现交叉现象属于正常,可以通过抗原亲和纯化得到特异性的抗体,较好改善交叉反应的现象(但由于纯化效率不可能达到100%,因此不能保证完全消除)
Q4,公司的WB是怎么做的?推荐的稀释比是多少?
A:
根据目的蛋白分子量选择合适的胶浓度,
根据所检测的样品及抗体数确定合适的验证模板,制SDS-PAGE胶/预制胶,垂直电泳,湿法转膜,丽春红染色确定转膜效果后进行WB验证,
常规定制抗体WB推荐稀释比例1:1000。


