
 2024-01-10 17:04:42
2024-01-10 17:04:42 背景:
大多数临床应用的癌症免疫疗法依赖于溶细胞型效应CD8+ T细胞直接识别和杀死肿瘤细胞的能力。这些策略主要受限于组织相容性复合体(MHC)缺陷肿瘤细胞的出现和免疫抑制肿瘤微环境的形成。CD4+载体细胞独立于CD8+ T细胞促进抗肿瘤免疫的能力被越来越多的认识,但释放其全部潜力的策略仍有待确定。文章中描述了一种机制,即少量CD4+ T细胞有可能根除MHC细胞逃避CD8+ T细胞直接靶向。CD4+载体T细胞优先聚集在肿瘤侵袭边缘,与MHC-II+ CD11c+抗原提呈细胞相互作用。研究发现,T辅助型1细胞通过干扰素激活的抗原呈递和表达iNOS的肿瘤杀灭载体表型指导CD4+ T细胞和先天免疫刺激肿瘤相关的髓系细胞网络重新编程。CD4+ T细胞和杀肿瘤髓系细胞共同协调了远程炎症性细胞死亡的诱导,间接根除了干扰素物反应和MHC缺陷的肿瘤。这些结果证明了临床利用CD4+ T细胞和先天免疫刺激剂的这种能力,以补充CD8+ T细胞和自然杀伤细胞的直接溶细胞活性的不足,并推进癌症免疫治疗。
研究目的:
这项研究的主要目的是探究CD4+ T细胞在对抗免疫逃逸型肿瘤中的作用机制。通过研究CD4+ T细胞如何诱导炎性细胞死亡,以及这种机制如何影响免疫系统对肿瘤的应对能力,研究人员试图揭示新的癌症治疗策略。
研究方法:
研究团队使用细胞培养、动物模型和分子生物学技术来分析CD4+ T细胞的作用机制。他们可能进行了肿瘤模型的建立,并观察CD4+ T细胞如何通过炎性反应引发肿瘤细胞的死亡。
图1、MHC表达的景观、肿瘤浸润CD8+ T细胞的分布和人类黑色素瘤转移的单细胞转录组。

图2、建立实验可处理的过继细胞转移模型比较CD4+和CD8+T细胞效应抗肿瘤功能和消除已确定的MHC II缺陷,通过MHC-II+肿瘤浸润免疫细胞上的间接抗原识别的黑色素瘤。
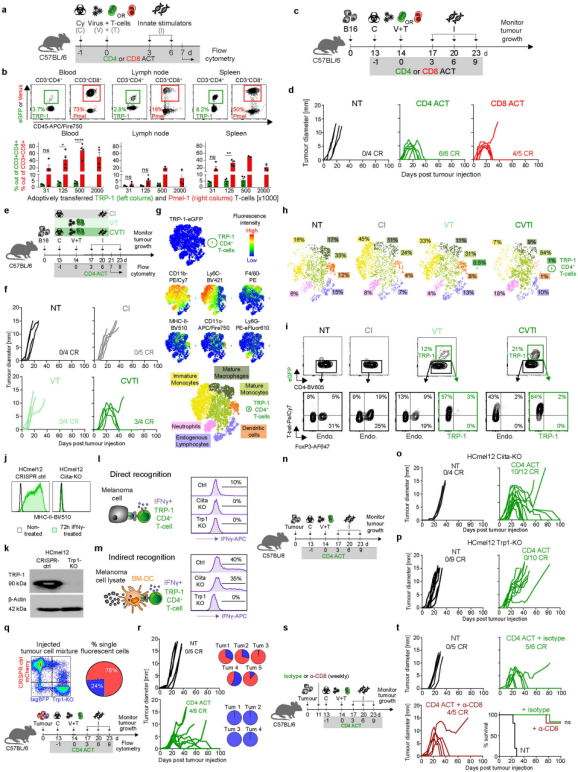
图3、CD4+和CD8+t细胞效应功能对缺乏MHC-I和MHC-II的IFN无应答肿瘤的比较评价。

图4、与CD8+效应t细胞相比,CD4+效应t细胞在肿瘤组织中表现出不同的空间分布和迁移行为。

……
图9、化学iNOS抑制和抗体介导的单核细胞和中性粒细胞消耗以及体外一氧化氮供体SNAP治疗表明,表达髓系细胞的iNOS在控制已建立的mhc缺陷和ifN无反应性黑色素瘤中发挥作用
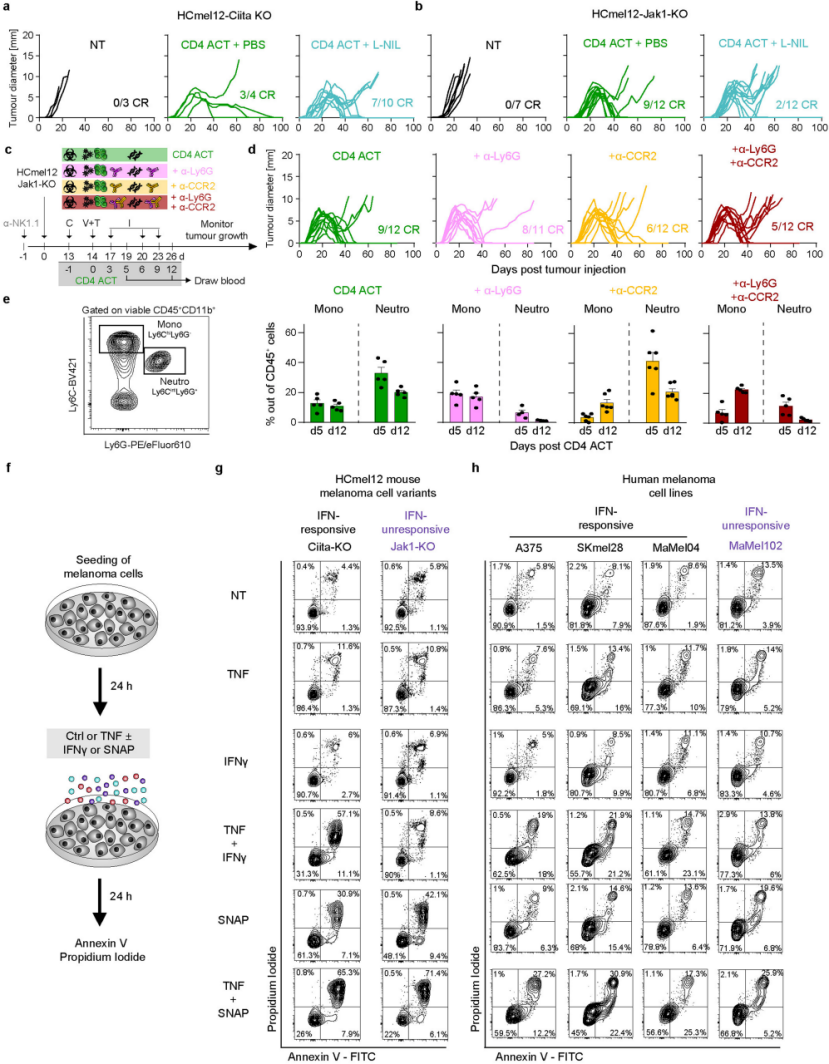
研究结果表明,CD4+ T细胞能够诱导炎性反应,进而导致肿瘤细胞的死亡。这一发现可能为免疫逃逸型肿瘤的治疗提供了新的思路。可能发现了涉及免疫调节和细胞死亡的关键信号通路,并对这些信号通路的调控产生了深入的了解。
这项研究成果可能具有重要的临床意义,为开发新的免疫疗法或靶向治疗策略提供了理论依据。通过了解CD4+ T细胞诱导的炎性细胞死亡机制,未来可能可以设计针对免疫逃逸型肿瘤的新型药物或治疗方法。
尽管这项研究结果具有重要意义,但仍然存在一些限制。可能需要进一步的临床研究来验证这些发现在人体中的适用性,并探索如何将这些发现转化为临床治疗的实际应用。未来的研究还可以进一步探究CD4+ T细胞和炎性细胞死亡在不同类型肿瘤中的差异性以及治疗响应的影响。
总体而言,这项研究揭示了CD4+ T细胞诱导的炎性细胞死亡在克服免疫逃逸型肿瘤方面的重要作用,并为未来的肿瘤治疗研究提供了新的方向和可能的治疗策略。
文献引用:
CD4+ T cell-induced inflammatory cell death controls immune-evasive tumours
Bastian Kruse, Anthony C. Buzzai, Naveen Shridhar, Andreas D. Braun, Susan Gellert, …Thomas Tüting
Nature volume 618, pages1033–1040 (2023)


