
 2024-03-18 23:13:56
2024-03-18 23:13:56 
本文主要研究了一种新型的脂质修饰的聚谷氨酰胺硫辛酸聚合物(G-LNPs),用于改善mRNA癌症疫苗的疗效和安全性。研究发现,G-LNPs可以显著提高负载mRNA的翻译效率,同时通过消除导致翻译抑制和炎症反应的活性氧,减轻疫苗接种后的炎症反应。体内研究表明,G-LNPsmRNA疫苗具有优秀的抗肿瘤效果,且通过协同免疫检查点阻断,肿瘤抑制效果进一步提升。
1、LNPs是广泛采用的mRNA传递系统,可以保护和传递mRNA药物。然而,当前的LNPs在翻译过程中会产生大量的活性氧,导致翻译效率降低,并引发炎症和其他副作用。
2、新型脂质修饰聚合物G-LNPs:研究人员合成了一种脂质修饰的聚谷氨酰胺硫辛酸聚合物,用于制造新型的LNPs,用于mRNA疫苗。这种G-LNPs可以显著提高负载mRNA的翻译效率,并通过消除活性氧来减轻疫苗接种后的炎症反应。
3、G-LNPsmRNA疫苗的疗效和安全性:体内研究表明,G-LNPsmRNA疫苗具有优秀的抗肿瘤效果,且通过协同免疫检查点阻断,肿瘤抑制效果进一步提升。这表明,G-LNPs-based mRNA疫苗将成为对抗癌症的强大且多功能平台。
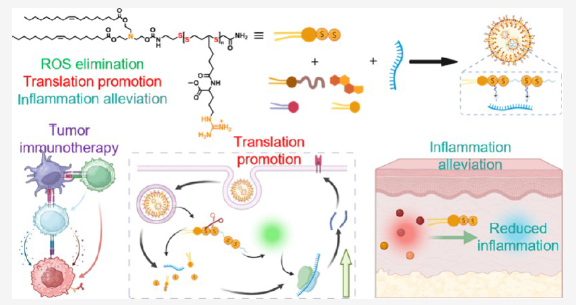
应用研究思路
疫苗效能提升:L-PGTA的引入,通过减少细胞内ROS水平,有效提升了树突状细胞(dendritic cells, DCs)中mRNA的翻译效率。这是因为ROS水平的升高会抑制mRNA的翻译,从而影响疫苗的效能。利用流式细胞术和ELISpot技术可以评估DCs对mRNA疫苗的处理和呈递能力,以及特异性T细胞的激活情况,这些都是疫苗引发免疫应答的关键步骤。
炎症反应的缓解:L-PGTA的ROS清除能力不仅提高了疫苗的翻译效率,还有效减轻了疫苗接种引起的炎症反应。通过测量接种后的ROS水平、炎症细胞因子的释放量等指标,可以评估疫苗的安全性。流式细胞术和ELISpot技术在这里同样适用,可以用于监测细胞因子的表达和特异性免疫细胞的反应。
体内药效评估:通过体内实验,研究了L-PGTA修饰的LNPs (G-LNPs)包裹的mRNA疫苗在促进肿瘤特异性T细胞应答和抑制肿瘤生长方面的效果。利用流式细胞术和ELISpot技术,可以细致评估疫苗诱导的T细胞活化程度、细胞因子的产生以及肿瘤浸润性T细胞的数量,这些指标直接反映了疫苗的抗肿瘤效果。
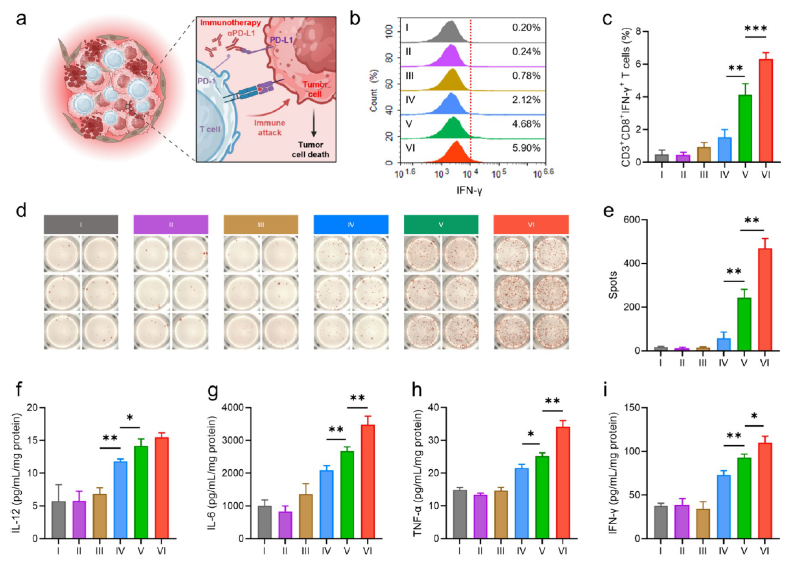
与免疫检查点阻断剂(ICB)的协同:研究还探讨了G-LNPsmRNA疫苗与免疫检查点阻断剂(如αPD-L1)联合使用的疗效。通过监测治疗后肿瘤组织中的T细胞渗透和细胞因子表达,评估联合疗法在克服肿瘤免疫逃逸和增强肿瘤免疫反应中的潜力。
总结
本文介绍了一种新型的混合脂质-聚合物药物传递系统G-LNPs,它成功地克服了传统药物传递系统的局限性,具有抗氧化性质和良好的生物相容性。通过流式细胞术和实验验证,G-LNPs在小鼠模型中表现出优秀的mRNA传递效果和安全性。这一创新性的药物传递系统为未来的基因治疗和疫苗研发提供了新的可能性,有望为人类健康事业作出重要贡献。
凯靖生物产品信息如下:
|
货号 |
品名 |
规格 |
|
mouse anti-human CD3 antibody, FITC |
100T |
|
|
mouse anti-human CD3 antibody, PE |
100T |
|
|
mouse anti-human CD3 antibody, PerCP |
100T |
|
|
mouse anti-human CD3 antibody, APC |
100T |
|
|
mouse anti-human CD4 antibody, FITC |
100T |
|
|
mouse anti-human CD4 antibody, PE |
100T |
更多产品信息请点击:抗体链接,橙色添加链接


