
 2024-03-20 21:37:25
2024-03-20 21:37:25 
胰腺导管腺癌(PDAC)是一种高度致命的癌症类型,其治疗效果受到肿瘤微环境(TME)中炎症和免疫调节信号的复杂互动的显著影响。在PDAC中,肿瘤相关巨噬细胞(TAMs)扮演着重要角色,但其多样性和复杂的功能一直阻碍着将其作为治疗靶点的努力。通过采用单细胞和空间基因组学结合功能实验,本研究揭示了IL-1β+ TAMs在促进PDAC病理性炎症中的关键作用,以及这一过程如何被肿瘤细胞驱动和维持。
研究背景
PDAC的治疗难度在很大程度上源于其TME的复杂性,其中炎症和免疫抑制程序共存并相互作用,导致传统治疗方法效果有限。尽管TAMs是PDAC免疫微环境中的主要组分,但它们的异质性和可塑性使得针对它们的治疗策略难以实现。本研究旨在通过深入了解TAMs的亚群特性和功能,特别是IL-1β+ TAMs,来揭示其在PDAC发展中的作用。
研究方法
单细胞RNA测序:从PDAC患者和小鼠模型中采集样本,使用单细胞RNA测序(scRNA-seq)技术分析TAMs的异质性。
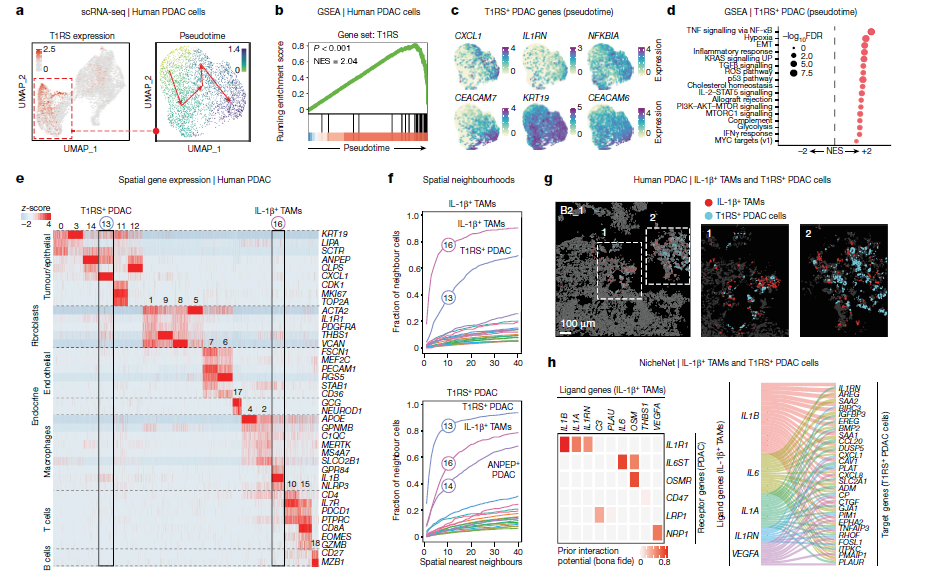
空间基因组学:应用空间转录组分析技术,探索IL-1β+ TAMs在肿瘤组织中的分布和与肿瘤细胞的空间关系。
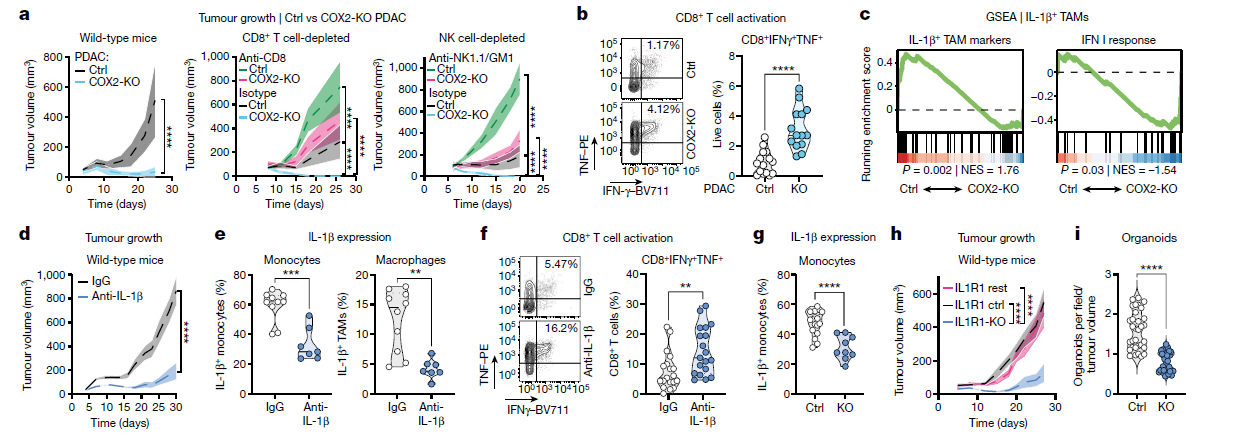
细胞功能验证实验:在体内外模型中阻断PGE2和IL-1β信号,观察对TAM功能和肿瘤生长的影响。
主要研究发现
1、IL-1β+ TAMs的发现:通过scRNA-seq,我们在PDAC中识别出表达高水平IL-1β的TAM亚群。这些IL-1β+ TAMs与炎症反应、白细胞招募和血管生成程序的活化相关。
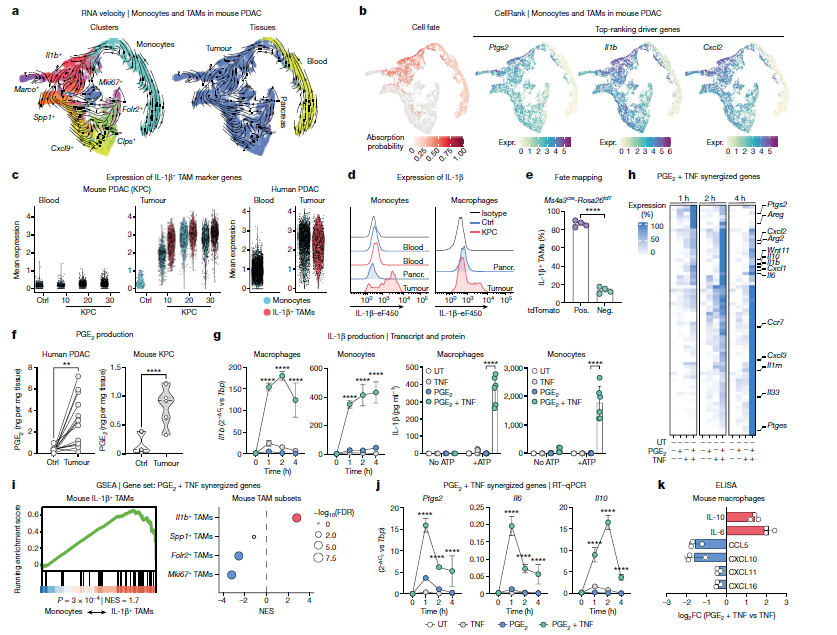
2、PGE2和TNF在IL-1β+ TAMs的激活中起关键作用:我们发现PGE2和TNF在TME中协同作用,促进IL-1β+ TAMs的形成和激活。
3、IL-1β+ TAMs与PDAC细胞间的相互作用:空间基因组学分析揭示了IL-1β+ TAMs与表达IL-1β响应签名(T1RS)的PDAC细胞在空间上的紧密关联,提示两者之间存在功能性相互作用。
结论与展望
本研究提供了对PDAC中IL-1β+ TAMs角色的深入理解,揭示了它们如何在肿瘤微环境中促进炎症和肿瘤生长,特别是通过与肿瘤细胞的相互作用。我们的发现强调了PGE2和TNF在调节IL-1β+ TAMs激活中的协同作用,以及这一过程如何影响肿瘤细胞的病理性重编程和肿瘤进展。
未来方向
机制深入:未来的研究需要进一步探索IL-1β+ TAMs和肿瘤细胞间相互作用的详细机制,特别是如何影响肿瘤细胞的遗传和表观遗传状态。
治疗潜力:我们的研究揭示了靶向PGE2–IL-1β轴作为治疗PDAC的潜在策略,未来需要评估这种策略在临床中的有效性和安全性。
预防研究:考虑到IL-1β+ TAMs在肿瘤早期阶段的作用,探索该亚群作为预防PDAC发展的潜在靶标具有重要意义。
结论
通过对PDAC中IL-1β+ TAMs的研究,我们不仅揭示了它们在肿瘤炎症和进展中的关键作用,也为开发新的治疗策略提供了基础。靶向PGE2–IL-1β轴有可能重新编程TME,从而抑制肿瘤生长并增强现有治疗的效果。我们的研究为深入理解PDAC免疫微环境的复杂性和开发针对性治疗提供了重要见解。
相关产品:
| 货号 | 品名 |
| K1049 | mouse anti-human CD45 antibody, APC |
| K1048 | mouse anti-human CD45 antibody, PerCP |
| K1047 | mouse anti-human CD45 antibody, PE |
| K1046 | mouse anti-human CD45 antibody, FITC |


